前沿
近年来,lncRNA在各个领域掀起研究热潮,关注度日益增加。但是植物lncRNA的研究步伐却明显落后于动物lncRNA,可是这并不代表植物lncRNA不重要。小米、水稻、杨树、沙棘、苜蓿和棉花等物种的lncRNA均已报道,但是这些研究多关注于lncRNA结构特征、表达模式的分析,而对lncRNA的具体机制的研究却相对较少。为了梳理植物lncRNA机制研究的思路,小编解读了植物中机制研究比较透彻的几个lncRNA案例。这些案例中,植物lncRNA通过多种方式参与调控植物开花、逆境响应和生殖生长等过程,我们可以借鉴案例中的研究思路进行机制研究。
更多的lncRNA知识,快来点我,点我,lncRNA定位、编码能力and结合研究——lncRNA研究进展(一)
1.COOLAIR、COLDAIR与春化作用
春化作用能够刺激拟南芥开花,其中FLC(Flower Locus C)是开花途径中的核心因子。COOLAIR与 COL-DAIR是FLC附近的两个lncRNA。COOLAIR的启动子能接受低温信号,从而在低温处理时COOLAIR被表达,并靶定FLC的3’端序列,使其发生降解。COLDAIR位于FLC的内含子区域,它能直接招募PRC2( POLYCOMB REPRESSIVE COMPLEX 2)蛋白复合体到这一区域完成甲基化,从而沉默FLC[1]。
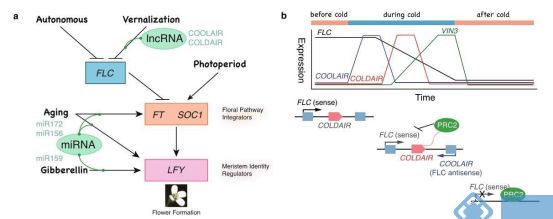
图1.COOLAIR与COLDAIR通过FLC影响拟南芥开花[1]
2.IPS1与磷吸收
lncRNA IPS1(INDUCED BY PHOSPHATE STAR-VATION1) 可以编码短肽,和磷饥饿诱导产生的miR399序列互补。同时,miR399也可以和PHO2( Phosphate Overaccumulator 2)序列互补结合。虽然IPS1和miR399碱基配对,但是在剪切位点却因碱基的错配而形成突起环。这一错配环抑制miR399对IPS1的降解,随后IPS1招募更多的miR399,竞争miR399对PHO2的结合。过表达IPS1导致PHO2转录本富集,导致茎尖磷含量降低。将该错配碱基突变(ips1PM),miR399降解PHO2影响其翻译[2]。
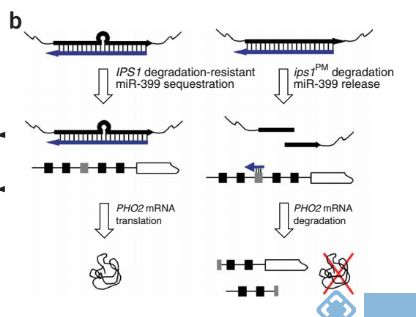
图2.IPS1和PHO2竞争结合miRNA399[2]
3.APOLO与生长素响应
APOLO(AUXIN REGULATED PROMOTERLOOP RNA)是位于PID基因上游5148bp位置的lncRNA,可以动态调控PID启动子的环化过程,从而影响PID启动子的活性。生长素激活ROD介导的DNA去甲基化,促进覆盖PID启动子区域的环打开。随后,PID与APOLO启动子的H3K27me3甲基化下降,H3K9Ac乙酰化程度上升,PID与APOLO表达量上调。Pol II 转录的APOLO随后逐渐招募 LHP1环化PID启动子,而Pol IV/V转录的APOLO促进DNA甲基化,维持环的稳定[3]。
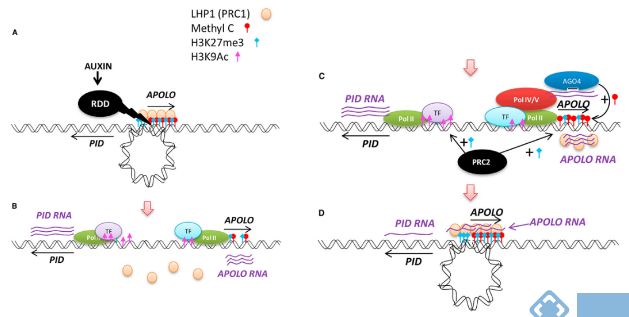
图3 .APOLO动态调节PID的表达[3]
4. ASCO-RNA与侧根发育
RNA结合蛋白AtNSRs(Nuclear Speckle RNA-binding Proteins)参与调控可变剪切过程,可以结合mRNA以及NOD40或lnc351等lncRNA。其中,这些结合的lncRNA被统称为ASCO-RNA(Alternative Splicing Competitor RNA ) 。ASCO-RNA能与mRNA竞争性结合NSRs,干扰NSR蛋白对下游生长素响应基因的可变剪切,从而影响侧根的生长[4]。
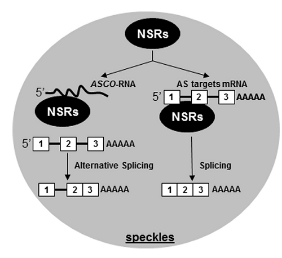
图4. ASCO-RNA与NSRs[4]
5.HID1与光形态建成
HID1(HIDDEN TREASURE 1)是长度为236nt的lncRNA,其T-DNA突变体hid1在持续红光条件下下胚轴伸长。HID1主要通过反式作用方式直接参与抑制光形态建成关键抑制因子PHYTOCHROME-INTERACTING FACTOR 3 (PIF3)基因的转录。HID1具有四个茎环结构,其中SL2和SL4是HID1在红光下发挥功能的关键结构,且这些结构具有保守性[5]。
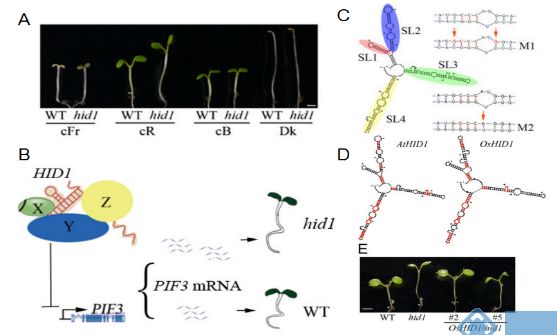
图5. HID1的作用机制[5]
6. LDMAR与水稻生殖发育
LDMAR(Long-day-specific Male-fertilityassociated RNA)是长度为1236nt的lncRNA ,研究表明其参与调控水稻生殖发育。在长光照条件下,LDMAR的表达维持水稻花粉正常发育。但是单碱基的突变改变LDMAR的二级结构,导致LDMAR的启动子区域的甲基化程度升高, LD-MAR 的表达量下降,花粉程序化死亡,最终导致光敏不育系[6]。
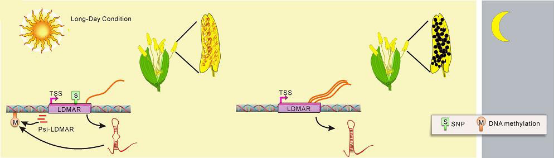
图6. LDMAR的作用机制[7]
二.小结
通过以上的案例解读,我们发现lncRNA可以通过表观遗传、转录及转录后水平参与调控植物开花、生殖发育和光形态建成等过程。而案例中,植物常见lncRNA的作用机制可供参考。通过转录组测序获得植物中的目标lncRNA后,大家可以借鉴案例中lncRNA的研究思路进行机制研究。
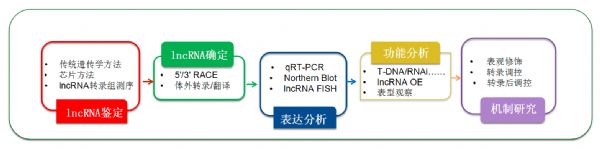
三.经典的植物lncRNA研究设计思路
近年来,借助lncRNA测序,越来越多植物物种的lncRNA均已经报道。植物lncRNA的研究思路通常是对不同处理或者不同发育时期的材料进行lncRNA测序,然后对目标基因进行挖掘,后续通过功能验证探索其作用机制,如图所示:
图7.经典的植物lncRNA研究设计思路
如果您想了解更多的转录组信息,欢迎大家关注在公众号“美吉生物”,或直接拨打总部电话:021-51875086,期待您的咨询呦。
参考文献
[1] Yamaguchi A, Abe M. Regulation of reproductive development by non-coding RNA in Arabidopsis: to flower or not to flower.[J]. Journal of Plant Research, 2012, 125(6):693-704.
[2] Francozorrilla J M, Valli A, Todesco M, et al. Target mimicry provides a new mechanism for regulation of microRNA activity[J]. Nature Genetics, 2007, 39(8):1033-1037.
[3] Ariel F, Jegu T, Latrasse D, et al. Noncoding transcription by alternative RNA polymerases dynamically regulates an auxin-driven chromatin loop.[J]. Molecular Cell, 2014, 55(3):383–396.
[4] Bardou F, Ariel F, Simpson C, et al. Long Noncoding RNA Modulates Alternative Splicing Regulators in Arabidopsis[J]. Developmental Cell, 2014, 30(2):166–176.
[5] Wang Y, Fan X, Lin F, et al. Arabidopsis noncoding RNA mediates control of photomorphogenesis by red light.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(28):10359-64.
[6] Ding J, Lu Q, Ouyang Y, et al. A long noncoding RNA regulates photoperiod-sensitive male sterility, an essential component of hybrid rice.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(7):2654-9.
[7] Zhang Y C, Chen Y Q. Long noncoding RNAs: new regulators in plant development.[J]. Biochemical & Biophysical Research Communications, 2013, 436(2):111-114.
更多的lncRNA知识,快来点我,点我,lncRNA定位、编码能力and结合研究——lncRNA研究进展(一)